Bei Gehirnerkrankungen wie Alzheimer, Parkinson-Syndrom, Epilepsie und depressiven Störungen gibt es noch zahlreiche unbekannte Elemente, die uns diese Krankheiten noch nicht in ihrer Ganzheit verstehen lassen. Der Fonds Brain Diseases wurde dazu geschaffen, Antworten auf diese Fragen zu finden.
Der Fonds Brain Diseases unterstützt nicht-klinische Grundlagenforschung an der Universität Zürich in Form von Nachwuchsförderung. Die Mittel des Fonds Brain Diseases setzt die UZH Foundation für jährliche Anerkennungspreise junger Wissenschaftlerinnen und Wissenschaftler in Form des UZH Award for Research in Brain Diseases ein, der 2006 erstmalig vergeben worden ist. Für die Vergabe der Mittel ist ein Förderbeirat zuständig.
Sie doktorieren und suchen nach einer Unterstützungsmöglichkeit, die Ihrer Forschung auf dem Gebiet von Gehirnerkrankungen Auftrieb gibt? Bewerben Sie sich für den Brain Diseases Award und stellen Sie sich einer hochkarätigen Jury, die Ihre Forschungsergebnisse professionell bewertet. Unter allen Einreichungen werden jährlich Preise à 10 000 Franken für besonders bemerkenswerte Forschungsleistungen vergeben. Bitte entnehmen Sie diesem Dokument die Teilnahmebedingungen (in Englisch). Senden Sie Ihre vollständigen Bewerbungsunterlagen jeweils per 30. April in einem PDF-Dokument an Prof. Dr. Amedeo Caflisch.
Teilnahmebedingungen Brain Diseases Award (English)
Der Förderbeirat besteht aus folgenden Mitgliedern:
Prof. Dr. Amedeo Caflisch, Direktor Biochemisches Institut UZH, Vorsitz
Prof. Dr. Sebastian Jessberger, Direktor Institut für Hirnforschung UZH
Prof. Dr. Ben Schuler, Biochemisches Institut UZH
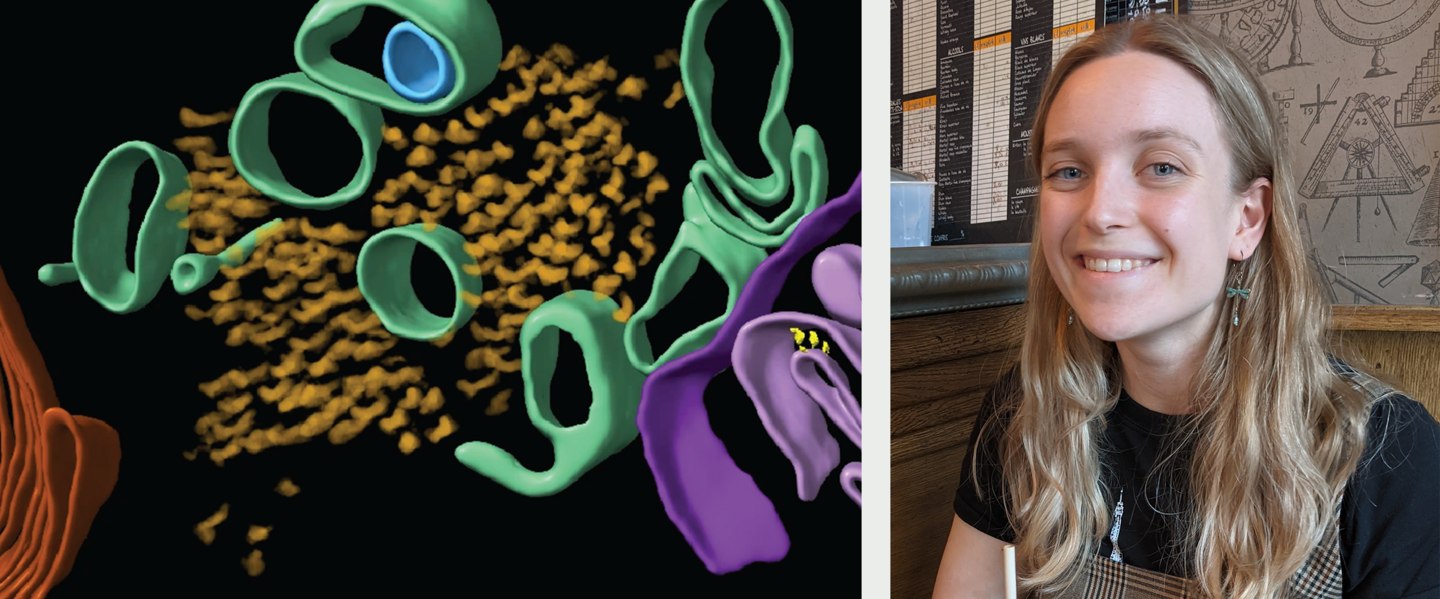
Die Alzheimer-Krankheit (AD) ist die häufigste Ursache für Demenz. Charakteristisch für AD ist die Selbstaggregation der Proteine Aβ und Tau zu fadenförmigen Strukturen, sogenannten Amyloiden, die pathologische Ablagerungen bilden. Diese stören die normale Funktion von Nervenzellen und tragen zu deren Absterben bei. Im Rahmen ihres Promotionsprojekts hat Madeleine Gilbert kryogene Elektronentomographie (cryoET) eingesetzt, um Aβ und Tau direkt im Gehirngewebe von Alzheimer-Patient:innen zu untersuchen. Dabei konnte sie neuartige Bestandteile von Aβ-Ablagerungen identifizieren, Unterschiede in der Organisation von Amyloidstrukturen entdecken und erstmals die strukturelle Faltung von Amyloidfilamenten in situ, also im nativen Gewebe, sichtbar machen. Diese Erkenntnisse liefern neue Einblicke in die Aggregation von Amyloid im Alzheimer-Gehirn und erweitern das Verständnis neurodegenerativer Erkrankungen.
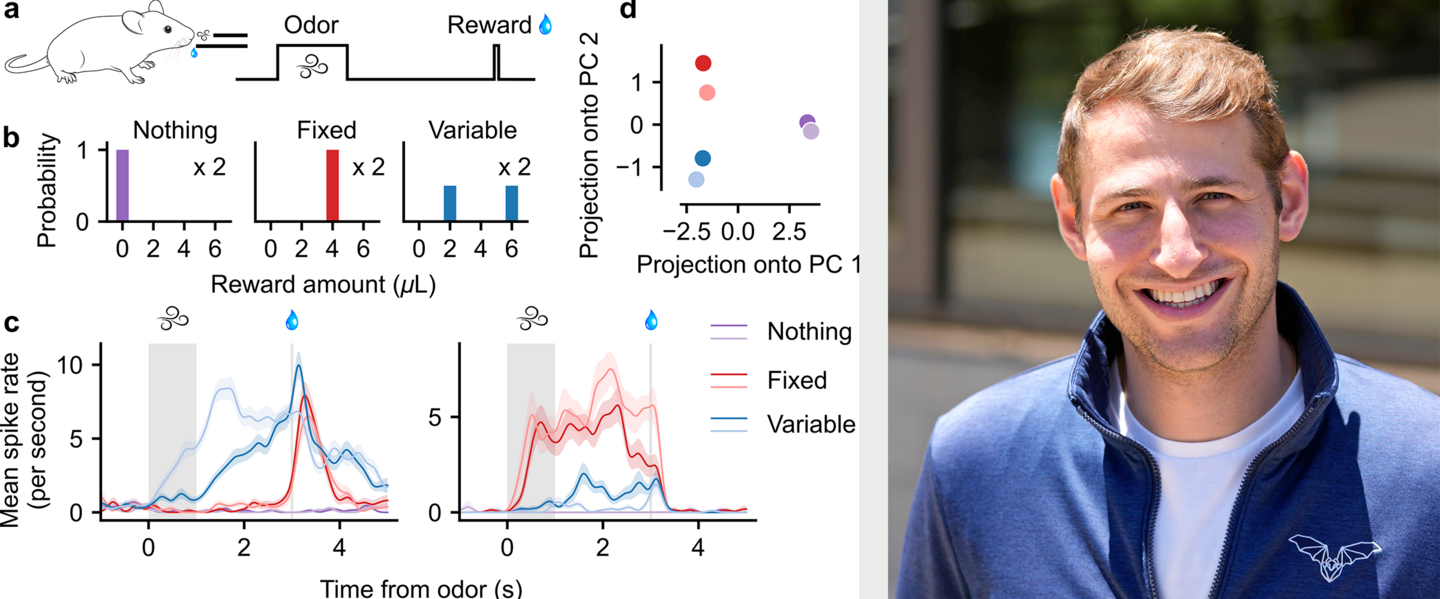
Lernen aus Belohnungen ist überlebenswichtig – und kann bei psychiatrischen Erkrankungen wie Depression, Sucht oder bipolaren Störungen tiefgreifend gestört sein. Während wir relativ gut verstehen, wie das Gehirn durchschnittliche Belohnungen verarbeitet, wissen wir bislang nur wenig darüber, ob und wie es ganze Belohnungsverteilungen lernt – ein Konzept, das in der modernen maschinellen Lernforschung zu deutlichen Leistungssteigerungen geführt hat. In seiner Promotion hat Adam Lowet die Gehirnaktivität von Mäusen aufgezeichnet, die darauf trainiert wurden, verschiedene Gerüche mit unterschiedlichen Belohnungsverteilungen zu assoziieren. Die Ergebnisse zeigten: Das Gehirn bildet nicht nur Wahrscheinlichkeitsverteilungen ab – bestimmte Zelltypen sind sogar bevorzugt auf die oberen oder unteren „Schwänze“ dieser Verteilungen spezialisiert. Durch gezielte Aktivierung oder Hemmung dieser Zelltypen ließ sich das Verhalten der Tiere entsprechend verändern. Diese empirischen Erkenntnisse hat Lowet in ein neues, biologisch fundiertes Rechenmodell überführt, das erklärt, wie verteilungsbasiertes Verstärkungslernen im Gehirn realisiert sein könnte – und damit neue Angriffspunkte für therapeutische Ansätze eröffnet.
Mit Blick auf die bisher vergebenen Mittel lässt sich eine erfreuliche Besonderheit feststellen: Mehr als 20 der 30 Preise für bahnbrechende Ergebnisse in der Gehirnforschung wurden an Doktorandinnen verliehen. Der Brain Diseases Award zeichnet somit nicht nur grosses Innovationspotenzial aus, er fördert gleichzeitig auch Frauen in der Wissenschaft.
2024 Linbi Cai, Universität Zürich
A nasal chemosensation–dependent critical window for somatosensory development
2024 Camille Testard, Harvard University
Primate Neurothology
2024 Roeltje Maas, Universität Lausanne
The local microenvironment drives activation of neutrophils in human brain tumors
2023 Daniel Gonzalez-Bohorquez, Universität Zürich
Rolle der de-novo-Lipogenese bei der kortikalen Entwicklung und intellektuellen Behinderungen
2023 Manuela Pérez Berlanga, Universität Zürich
Verlust der TDP-43-Oligomerisierung oder RNA-Bindung führt zu unterschiedlichen Aggregationsmustern
2023 Yi Xiao Jiang, UCLA
Amyloidfibrillen bei FTLD-TDP bestehen aus TMEM106B und nicht aus TDP-43
2022 Sydney E. Cason, University of Pennsylvania
Sequential dynein effectors regulate axonal autophagosome motility in a maturation-dependent pathway
2022 Fadi Jacob, Johns Hopkins
A Patient-Derived Glioblastoma Organoid Model and Biobank Recapitulates Inter- and Intra-tumoral Heterogeneity.
2022 Lyle Kingsbury, UCLA
Correlated Neural Activity and Encoding of Behavior across Brains of Socially Interacting Animals
2021 Ekaterina Friebel, Universität Zürich
Single-Cell Mapping of Human Brain Cancer Reveals Tumor-Specifiv Instruction of Tissue-Invading Leukocytes
2021 Dasha Nelidova, Universität Basel
Restoring light sensitivity using tunable near-infrared sensors
2021 David Tingley, NYU Neuroscience Institute
Routing of Hippocampal Ripples to Subcortical Structures via the Lateral Septum
2020 Claire Gizowski, UC San Francisco
Interplay between peripheral signals, behaviour and the central clock
2020 Sofie Ährlund-Richter, Karolinska Institute
On the Neuronal Correlates of Cognition: Cell-type specific Circuitry and Function of the Prefrontal Cortex
2020 Xuyu Qian, Harvard University
Modeling Human Brain Development and Disorders Using HiPSC-derived Organoids
2019 Sara Bottes, Universität Zürich
Live imaging of neurogenesis in the adult mouse hippocampus.
2018 Gioele La Manno, Karolinska Institute, Stockholm
RNA velocity in single cells.
2017 Tobias Wauer, University of Cambridge
Structure of the human Parkin ligase domain in an autoinhibited state.
2016 Lisa Traunmüller, Universität Basel
Control of neuronal synapse specification by a highly dedicated alternative splicing program.
2015 Anne Maass, University of Magdeburg
Vascular hippocampal plasticity after aerobic exercise in older adults.
2014 Katharina Gapp, Universität Zürich
Implication of sperm RNAs in transgenerational inheritance of the effects of early trauma in mice.
2014 Marc Aurel Busche, TU München
Clusters of hyperactive neurons near amyloid plaques in a mouse model of Alzheimer's disease.
2013 Sandra Giovanoli, ETH Zurich
Stress in puberty unmasks latent neuropathological consequences of prenatal immune activation in mice.
2012 Amelie Ebke, LMU München
Novel γ-secretase snzyme modulators directly target presenilin protein.
2011 Stéphanie Vuillermot, ETH Zurich
The recombinant amyloid-beta peptide Abeta1-42 aggregates faster and is more neurotoxic than
synthetic Abeta1-42.
2010 Andreas Vitalis, Washington University in St. Louis
Quantitative characterization of intrinsic disorder in polyglutamine: insights from analysis based on
polymer theories.
2010 Verena Finder, ETH Zürich
The recombinant amyloid-beta peptide Abeta1-42 aggregates faster and is more neurotoxic than
synthetic Abeta1-42.
2009 Susanne Schneider, University of Lübeck
Mutations in the THAP1 (DYT6) gene- a cause of generalized dystonia with prominent spasmodic dysphonia.
2008 Carsten Sachse, University of Jena
Paired β-sheet structure of an Aβ(1-40) amyloid fibril revealed by electron microscopy
2008 Anat Frydman-Marom, University of Tel Aviv
Cognitive performance recovery of Alzheimer's disease model mice by modulating early soluble
amyloid assemblies.
2007 Eline Vrieseling, Universität Basel
Target-induced transcriptional control of dendritic patterning and connectivity in motor neurons by
the ETS gene Pea3.
2007 Marlen Knobloch, Universität Zürich
Intracellular Aβ and cognitive deficits precede β-amyloid depositiobloch UZH'Intracellular Aβ and cognitive deficits precede β-amyloid depositiobloch UZH'Intracellular Aβ and cognitive deficits precede β-amyloid deposition in transgenic arcAβ mice.
2006 Mathias Heikenwälder, Universität Zürich
Chronic lymphocytic inflammation specifies the organ tropism of prions.
